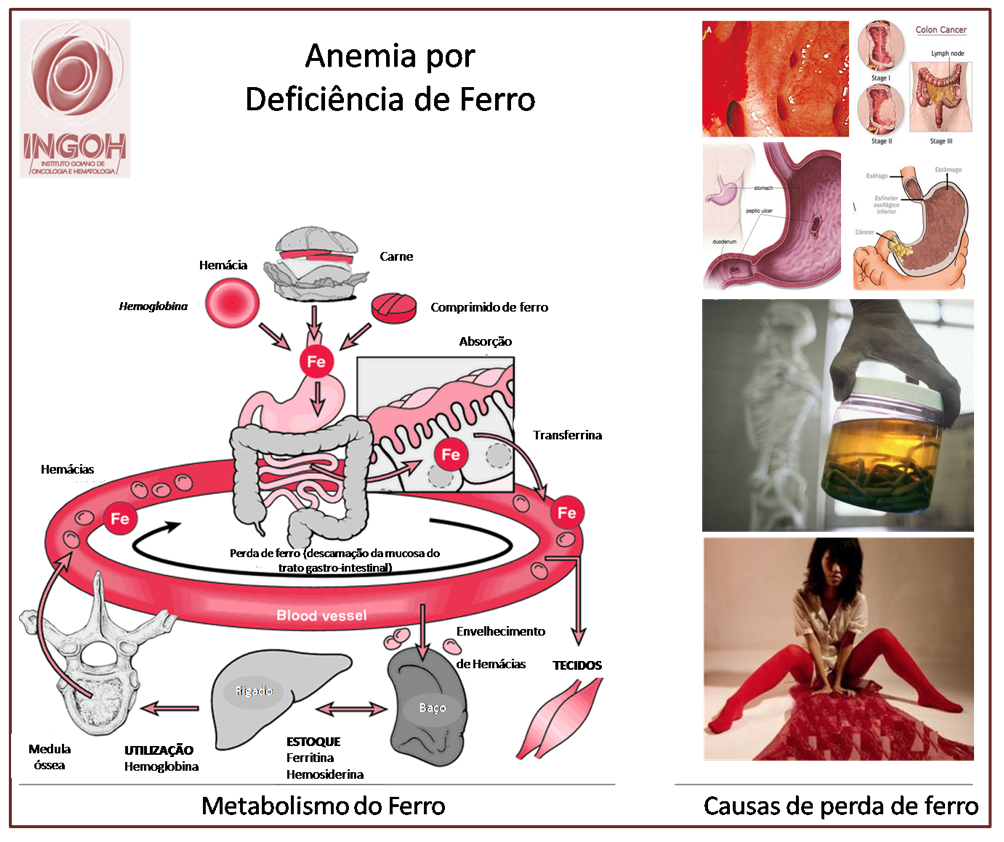
A síndrome mielodisplásica é uma forma de anemia crônica que aparece com ou sem outras alterações nas células do sangue.
Para manter uma quantidade estável de células no sangue, é necessário que este seja produzido continuamente pela stem cell (ou célula tronco), que origina todas as células do sangue e se encontra na medula vermelha dos ossos, também chamado de tutano. As stem cell são células pluripotentes que vão se proliferando e diferenciando até que se tornam células maduras. Em um determinado ponto da diferenciação já conseguimos dizer qual célula será originada. Podemos visualizar, por exemplo, linfoblastos e linfócitos. Chamamos estes últimos de linhagem linfoide. Todas as outras células da medula (que não são da série linfoide) são de linhagem mieloide. Assim, os eritroblastos originam hemácias, os megacariócitos originam plaquetas, os mieloblastos originam os neutrófilos, eosinófilos, basófilos e os monoblastos dão origem aos monócitos.
Nas Síndromes Mielodisplásicas (SMD), uma doença da série mieloide, a medula óssea não funciona normalmente, podendo apresentar células anormais e não produzir células sanguíneas maduras normais e/ou em quantidade suficiente. Em outras palavras, pode a stem cell pode proliferar, mas a diferenciação é anormal e a produção de células maduras não é eficiente, o que é percebido no hemograma como uma redução nas células do sangue, que pode afetar uma ou mais séries (vermelha, branca e/ou plaquetas). É considerada uma doença que apresenta potencial relativo de se transformar em Leucemia Aguda nos anos subsequentes.
Algumas pessoas com SMD não têm sintomas. Quando têm, esses sintomas podem ser tontura, fraqueza ou cansaço, dificuldade para respirar e até dificuldade de pensar claramente, que são sinais de anemia. Podem apresentar manchas roxas ou sangrar mais facilmente, que são sinais de plaquetas baixas. Outra situação que chama a atenção para a necessidade de avaliação especializada é quando se tem infecções de repetição (secundário à redução das células de defesa, chamadas de neutrófilos), principalmente quando há necessidade de uso de antibiótico mais do que três vezes ao ano.
Os principais exames para avaliar se existe a SMD são o hemograma (que avalia as células no sangue periférico: hemácias, leucócitos e plaquetas), o mielograma (que avalia as células da medula óssea) e o exame de citogenética (que avalia a presença de alterações nos cromossomos, onde se encontra nosso material genético). Recentemente alguns painéis moleculares (NGS mieloide) vêm sendo disponibilizados e são úteis quando os exames acima não foram conclusivos. Servem também para estabelecer o risco da doença. Os exames de biópsia de medula (histopatológico) e de imunofenotipagem, além do ferro medular também são muito úteis em determinadas situações tanto para diagnóstico quanto para classificação da SMD. É importante saber quantas e quais são as citopenias (quantas e qual a gravidade da anemia, leucopenia e/ou plaquetopenia), se há e qual é a alteração citogenética e qual a porcentagem de blastos na medula. Esses fatores são considerados prognósticos e existem alguns escores que ajudam o médico na decisão terapêutica.
O tratamento vai depender, em grande parte, do subtipo de SMD, dos sintomas apresentados e da idade do paciente. A maioria dos tratamentos não cura, mas podem melhorar os sintomas e ajudam o paciente a se sentir melhor. Para isso, pode ser necessário transfusões de sangue e medicamentos como os fatores de crescimento hematopoético. Alguns quimioterápicos, como a azacitidina e a decitabina, também podem ser utilizados em grupos de alto risco e, recentemente, a associação desses medicamentos como venetoclax (inibidor do BCL-2) vem sendo indicada para casos selecionados. Inúmeros medicamentos vêm sendo testados para pacientes com algumas alterações moleculares específicas. A lenalidomida, por exemplo, já é indicada há muitos anos para pacientes com deleção 5q. O transplante de medula óssea (atualmente chamado de transplante de células tronco hematopoéticas, ou TCTH) é recomendado para pessoas dos grupos de maior risco, menores de 75 anos, sem comorbidades relevantes e que tenham um doador, não sendo recomendado para pessoas com menor risco de doença. Apesar de liberado até os 75 anos, pacientes com mais de 60 anos, que tenham condições clínicas de receber o transplante, devem receber regimes de condicionamento de intensidade reduzida.
Texto elaborado e revisado por
Dra. Mireille Guimarães Vaz de Campos
Médica do corpo clínico do INGOH
Especialista em Hematologia – Hemoterapia
CRM-GO 12.406/RQE 22965.
Texto revisado em Agosto de 2022.
É permitida a reprodução parcial
ou total desta obra, desde que
citada a fonte e que não seja para
venda ou qualquer fim comercial
Referências:
-
CHAUFFAILLE MLLF. Neoplasias mieloproliferativas: revisão dos critérios diagnósticos e dos aspectos clínicos. Rev. Bras. Hematol. Hemoter. 2010;32(4):308-316 (Principal, mas os critérios foram atualizados na última versão do livro da OMS)
-
FIGUEIREDO MS, KERBAUY J, LOURENÇO DM. Hematologia – Guias de Medicina Ambulatorial e Hospitalar UNIFESP-EPM. Manole, 2011.
-
ZAGO MA, FALCAO RP, PASQUINI R. Tratado de Hematologia. Atheneu, 2014.
-
CONITEC. Ministério da Saúde. Protocolo clínico e diretrizes terapêuticas da leucemia mieloide crônica do adulto – Brasília: Ministério da Saúde, 2020. Disponível em: http://conitec.gov.br/images/Consultas/Relatorios/2020/PCDT_LeucemiaMieloideCronicaAdulto_CP_02_2020.pdf
-
SWERDLOW SH ets al. WHO classification of Tumors of Haematopoietic ans Lymphoid Tissue. IARC: Lyon, 2017.